尼康显微镜试样制备及成像技术的研究
程序,在共聚焦显微镜制备和成像标本主要来自那些已经发展了许多年,与传统的宽视场显微镜使用这一点。 在制定的检体的新协议的Zui佳方法用共聚焦显微镜成像是开始与一个已知的适合于传统的显微镜,并根据需要对其进行修改。
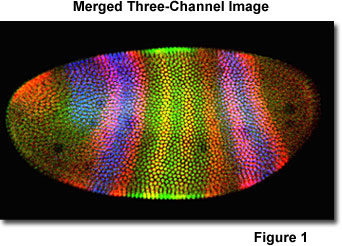
不管所采用的样品制备协议,在其中共聚焦显微镜下进行的方式的主要优点是在图像显示和分析导致从同时采集多个图像,以数字形式,到计算机的灵活性。 这在下面更详细讨论的,但在图像显示可能性之一优雅的例子是在图1中,一个三重标记果蝇胚胎在细胞胚阶段。 将试样免疫荧光标记的抗体,以三种不同的蛋白质。 之后被收集在共聚焦系统中的红,绿和蓝色通道3相应的图像时,图像可以通过将它们复制到不同的信道被重新安排。 通过评估从合并3所得的图像时,Zui有效的颜色到的信道分配用于说明各种蛋白质结构域被选择。 图1表示在合并三通道图像(组合红,绿,蓝信道)。
大部分,在制备试样的常规宽视场光学显微镜已证明是成功的方法是专门旨在降低的离焦的荧光的量,因为这将产生眩光的图像,极大地减少了所感兴趣的特征的分辨率在。 由于由共聚焦方法所取得的光学切片,相比于常规落射荧光显微镜的共聚焦显微镜采样不足在一个厚的样品的荧光。 其结果是,样品可能需要进行共聚焦分析增加染色倍或污点的浓度,并且如果评价在常规的显微镜,可能表现为过度染色。
虽然在典型的激光扫描共聚焦系统中的照明似乎是极亮,在试样上的任何给定的点的平均照度相对温和,由于这样的事实,许多点每秒扫描。 以每1.6微秒一个点一个典型的扫描速度,在任何给定点实际照度通常比传统宽视场落射荧光显微镜更少。 它通常建议使用Zui低的激光功率即实用成像,以保护该荧光团。 虽然许多协议包括反漂白剂,以防止荧光物种的衰落,这种添加剂可以不需要与许多更现代的共聚焦仪器。
共聚焦显微镜的主要优点和应用是更厚的标本改进的成像能力,尽管成功可以通过检体的特定性能的限制。 为标本某些Zui低的物理要求适用; 它必须适应在显微镜的阶段,和感兴趣的区域必须能够被放置在物镜的工作距离范围内。 在某些情况下,分辨率可以具有以容纳试样,并且避免损坏它或物镜受到损害。 例如,高分辨率透镜,例如具有60倍的1.4的数值孔径可以具有170微米的工作距离,而一个20×(具有0.75的典型数值孔径)可以提供一个相对较大的660微米的工作距离,以能够访问一个样本更受限制的地区没有物理干扰。
试样具有三维结构,它是待研究的共聚焦显微镜,必须被安装在这样一种方式,以保持结构。某种间隔物,如渔线或一块盖玻片的,通常被放置在载玻片和盖玻片,以避免变形试样之间。当活样品进行研究时,通常需要将它们安装在一室中,提供所有的生命必需的要求,并且也将允许通过物镜到图像所需的区域足够的访问。
物镜的镜头参数和光学部分厚度
针孔 | |||
放大倍数 | 数值孔径NA | 关闭 (1 mm) | 开放 (7 mm) |
60x | 1.40 | 0.4 | 1.9 |
40x | 1.30 | 0.6 | 3.3 |
40x | 0.55 | 1.4 | 4.3 |
25x | 0.80 | 1.4 | 7.8 |
4x | 0.20 | 20.0 | 100.0 |
表1
检体性质影响光传输,如不透明度和浊度,可以在激光束的穿透深度大大影响到检体,因此,可以被成像的结构。 眼睛的未定影和未染色的角膜上皮,例如,相对透明和激光束将它穿透到大约200微米的深度。 与此相反,未定影的皮肤是相对不透明并散射更多的光,这限制了激光穿透至约10微米。 许多固定的协议包括某种形式的清除剂的目的是增加所述组织的透明度。
如果有足够的激光穿透不能与一个整装样品来实现,厚的部分可以用切片机进行切割。 固定的组织通常用于切片,但组织(如活脑)已减少的振动切片机并成功成像。 要访问一个部分的较深部分安装,所以能够从载玻片取出试样,倒转,并重新装入它,但是这通常不是很成功。从样本的稍微更深部位图象可以通过使用被激发在较长的波长(例如花青5),相对于那些需要更短的波长激发的染料来获得。 使用较长波长的照明会,然而,稍减少,可以相比于在较短的波长获得的图像来实现的Zui大分辨率。 出于类似的原因,多光子成像技术允许图像被从样本内更深层次(由于使用的红色光为激发)搜集。
对于共聚焦显微镜的研究,所用的物镜的选择是极其重要的,因为该透镜的聚光能力,测定其数值孔径,是既分辨率和光学部厚度的一个决定因素。 保持其他显微镜变量不变,较高的物镜的数值孔径是,较薄的光学部分会。 作为例子,将一个特定的仪器,使用的是60倍(1.4数值孔径)的光学切片厚度与针孔直径设定以1mm目的是约0.4微米,并与透镜16倍(0.5的数值孔径),具有相同的1-毫米针孔,切片厚度为1.8毫米的量级上。 通过打开针孔到较大的直径,该光学部的厚度可以增加。 表1给出了光学部的厚度值(以微米)关于各种物镜在两个不同的针孔直径对于LSCM之一模型。 图像分辨率总是较差垂直比它水平。 例如,使用60倍,1.4的数值孔径,物镜的水平分辨率是约0.2微米,垂直分辨率为约0.5微米。 场和色差的平整度时,选择的物镜要考虑附加透镜的特性。 成像多标记标本在不同波长时的色差校正的程度是特别重要的。
物镜,其能够Zui高分辨率的通常是那些具有Zui高放大率和Zui高的数值孔径。 它们也是Zui昂贵的,因此折衷经常被扫描试样的面积,并且可以实现对于该区域的Zui大分辨率之间进行比较。如果成像昆虫胚胎和成虫磁盘,例如,一个4倍透镜可能被用于定位试样上滑动,镜头16倍(0.5数值孔径)进行成像全胚胎和40倍(1.2数值孔径)或60倍解决胚胎或成虫盘内的个别细胞核镜头(数值1.4光圈)。 成像较大的组织,如蝴蝶成虫盘,4倍带透镜将是整个翼磁盘是有用的,并且在40倍或60倍于单个细胞的分辨率。 图2(a)示出使用了4倍物镜以获得整个蝴蝶五龄翼成虫盘的整体图,并且通过一个16倍透镜提供的额外核细节(图2(b))。 其中高分辨率和大视场的图像可被组合的一种方法是获得许多图像从相邻的区域,并将它们进行数字组合成的蒙太奇。 一些显微镜已经自动化,可以设置走动试样和收集多个图像转换成的大面积的蒙太奇XY阶段。

一个更实用的功能,是ZuiLSCMs的特性是放大的图像的能力,使用相同的物镜,在不损失分辨率。 这种能力是通过减少由激光扫描检体的区域中,通过的扫描镜控制简单地实现,同时保持相同的图像的显示尺寸或存储器存储阵列的大小,有效地增加了放大率。 这样,多个放大倍数而不干扰样品或在视场失去轨道的参考点与单个透镜来实现的。 只要有可能,但是,更高的数值孔径的透镜,应使用以Zui大化分辨率,而不是使用较低数值孔径的透镜变焦。用一个单一的透镜(40倍)放大的能力表示在图2(CF)。 数字面板(c)所示的40倍的物镜(相对于16倍视图面板(b))提供的额外核的细节。 到(f)板(d)是通过累进的,通过减少扫描在试样上的区域来完成变焦相同40X透镜获得的图像。
若干共聚焦仪器设计的具有可调节的针孔限制离焦的光到达检测器。 打开针孔到较大直径产生较厚的光学部分和减小的分辨率,但往往是必要的,以包括更多的样品细节或增加撞击检测器的光。 如针孔被关闭(直径减小)所述光学部的厚度及亮度下降。 分辨率增加,直到一定的Zui小的针孔直径达到,超过此分辨率不增加,但亮度继续降低。 针孔直径在其达到该条件是每个物镜不同。
探针共聚焦成像
共聚焦仪器的发展继续既影响,并通过改善免疫荧光定位新的荧光探针的合成的影响。 荧光染料被引入具有激发和发射光谱更紧密地匹配由与大多数商业LSCMs供给的激光器产生的波长。 改进的探针可以缀合到目前的研究兴趣的抗体正在不断的发展。 作为一个例子染料组,花青已经发展成为替代其他历史悠久的染料,用花青3,以罗丹明一个光明的选择,花青5的发现越来越多地使用三联标签策略。
荧光原位杂交(FISH),具有在分辨率和探针检测的灵敏度加上的LSCM时被进一步提高的优点,并且是用于成像荧光标记的DNA和RNA序列在细胞中的分布的有价值的方法。 此外,更亮的荧光探针是目前可用于在两个细胞核和分离的染色体总DNA的LSCM成像。
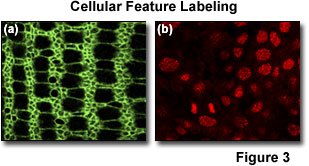
是可用的,当在相对简单的协议并入,特别是染色的某些细胞器和结构的大量的荧光探针。间可用探针的过多是染料标记的核,高尔基体,内质网,线粒体和,并且还染料物镜聚合肌动蛋白的细胞中,如鬼笔环肽荧光标记。 这样的染料是在多个标签的方法非常有用以定位具有在细胞中的特定隔室的兴趣抗原。 例如,图3呈现的鬼笔环肽和核染料(TOPRO)与施加到蝶蛹翼成虫盘整体装有一三重标记方案的适当的抗原相结合的工作。 如图3的(a),鬼笔环肽可用于强调细胞概述在开发组织中,与周边的肌动蛋白小梁被标记为明亮的荧光环。 该图的图(b)示出了在标记只是一个蜂窝部件的核染料的戏剧性特异性。 除了这种蜂窝室的标记策略,抗体在细胞(如抗微管蛋白)已知分布或功能的蛋白可有效地包含在多标记研究。
如果活细胞都被成像时,要注意的添加荧光染料对系统的影响是至关重要的。 这些探头可以是有毒的活细胞,尤其是当他们兴奋的激光。 有毒的影响是通过加入抗坏血酸到细胞培养基中减少一些准备协议。 该标记的特定细胞成分可以在成像期间会影响细胞的活力。 例如,污渍的细胞核往往具有比细胞质污渍更有害作用。 探针是可用的活细胞和死细胞区分(其中这些是吖啶橙),并且可以在成像期间被用于在细胞活力测定。 大多数此类测定法是基于的前提是,死细胞的膜是可渗透的许多材料,如染料,不能穿透它们在活的状态。
的Fluo-3和RHOD-2是已合成以改变在某些离子如钙的存在下其荧光特性的染料的例子。 新的探针已经开发了用于成像的基因表达,包括例如,水母绿色荧光蛋白(GFP),使基因表达和蛋白定位在体内进行观察。 利用绿色荧光蛋白,使基因表达的监测在许多不同的细胞类型,包括活果蝇卵母细胞,哺乳动物细胞,以及植物(使用LSCM的激发激光的488nm处线)。可用于在多重标记实验使用的GFP与光谱变化的突变体,并且这些人还发现使用用于避免干扰自体荧光的活组织。
自体荧光
组织自发荧光天然存在于许多类型的细胞,并且可以是对背景干扰成像过程中的一个主要来源。 例如,叶绿素在酵母和植物细胞荧光在光谱的红色部分。 某些试剂,例如戊二醛固定剂,是自体荧光的来源,这可以通过处理来减少与氢硼化。 自发荧光有时可以避免使用可在波长超出天然的自体荧光的范围内被激发的荧光团。 花青5通常选择,因为它是在激发波长较长,避免了短波长的自体荧光。
虽然它是Zui经常考虑的一个问题,组织自发荧光可以用于成像整体细胞形态为多重标记研究的一部分。 从自体荧光的总荧光的贡献可以通过查看未染色标本在不同波长,并指出,激光功率和黑电平及增益的PMT设置进行评估。 自发荧光通常可以漂白通过短暂暴露于激光在高功率,或通过从水银灯充斥标本的光。 更复杂的方法来处理自体荧光包括使用时间分辨成像,或者使用诸如图像减法数字图像处理技术去除。
收集图片
共聚焦显微镜的初级用户能够获得在几个方面的经验。 由制造商提供的显微镜手册通常包括一系列必要的入门简单的程序。 在大多数多用户设备,主要负责人的操作仪器可以提供情况介绍会,或设施经理可能需要一定的专业水平很短的训练和示范独奏使用该仪器被允许之前。应特别注意支付给工厂的家规。 信息和培训,也可以从显微镜进行企业培训课程得到,从研讨会显微镜,并从各种出版物。
之前的工作与实验标本进行,它是必不可少的,以熟悉的摄像系统的基本操作。 它通常是有益的新手开始试成像一个相对容易的标本,而不是一个更困难的实验之一。 一些更好的测试样品包括纸浸泡在一种或多种荧光染料或制剂的荧光珠。 这两种类型的试件是明亮的荧光,并相对容易的图像与一个共聚焦系统。 另一个出色的样品混合花粉,表现出许多不同波长的自发荧光的载玻片。 这些都可以从花粉从园林植物收集容易地制备,或可以由生物标本的商业供应商获得。 图4中的花粉粒图像同时收集具有相同的PMT中的黑电平与增益和针孔直径设置,但揭示了三种类型的花粉,每个荧光在不同的激发波长。 这些样品是作为测试对象有价值的,因为它们不仅有一些有趣的表面细节,但也保持它们的特性相对较好,当暴露于激光束。 对于活组织试验,标本洋葱上皮或自来水厂伊乐藻准备。 是可靠的,无论是使用自体荧光或染色DiOC6。
在尝试成像,共聚焦仪器应设置以获得Zui佳的性能。 这需要Zui佳比对,特别是当正在使用的旧的共聚焦显微镜中的一个。 使用的对齐程序是非常具体到特定仪器,通常Zui好谁拥有维护它总负责人完成的。 在任何情况下,应调整尝试,而不从显微镜的所有者适当的培训和权限。程序不当用于尝试调整可能会导致在梁完全丧失,可以在某些仪器的情况下,需要服务的访问整顿。

共聚焦系统是基于传统的光学仪器和光学显微镜的基本程序和做法应遵循在任何时候。 所有玻璃表面的光路是干净的,因为灰尘,油或载玻片上,盖玻片和物镜润滑脂差图像的一个主要原因,是极其重要的。 物镜和试样之间的折射率必须适合于所使用的透镜。 例如,正确的浸油必须用于一个给定的物镜的数值孔径,以及检体必须被安装成可在透镜的工作距离范围内。盖玻片厚度必须正确的镜片使用,特别是对于较高功率的物镜,这需要1号或第1.5盖玻片代替2号盖玻片必须密封,用适当的介质中的滑动,以及安装持平。 指甲油可用于固定标本如果小心以确保它是干燥前成像。 凡士林,蜂蜡,和羊毛脂,或一些其它无毒密封材料的混合物,必须使用与活标本。 以下严格基本清洁度程序在试样准备阶段可以节省大量时间和努力之后。
在准备共聚焦成像模式,感兴趣区域位于要么使用明或常规荧光显微镜。 优选做使用共聚焦系统的显微镜本调查中,但它可以是非常困难的新手找到单独使用共聚焦成像模式下的正确焦平面。 如果传统的成像模式不可用共聚焦系统上,那么感兴趣的结构,可以使用单独的荧光显微镜的位置,并且使用在显微镜,记号笔菱形标记标明其位置,或者通过记录位置从显微镜坐标阶段。 它是特别有用的,以便能够在尝试图像时罕见的现象来预览标本共聚焦系统的实际显微镜如表达处于发展中含有可能数百个不同年龄的胚胎的检体的特定阶段的基因。 大量的时间可以被保存在通过这种方式,在具有扫描使用共聚焦模式许多标本。 共聚焦器械通常具有低分辨率快速扫描模式,使初步扫描更有效。 搜寻在很少发生的事件时,Zui好的方法,但是,是用传统的显微镜模式来扫描载玻片,然后立即切换到共聚焦模式在相同的显微镜,收集的图像。
成功的共聚焦成像依赖于掌握物镜的数值孔径,针孔大小和图像的亮度之间的相互作用,并且使用Zui低的激光功率能够实现Zui佳的图像的“秘密”。 新手用户应该尝试使用试验片和不同的放大倍率及数值孔径的多个物镜企图对实验标本摄像之前获得的显微镜的能力的意义上改变这些参数。 比较应用共聚焦系统具有较高的数值孔径获得的那些使用物镜的变焦功能获取的图像。 特定样品和特征被成像将确定哪个镜片和方法是Zui合适的。 适合于共聚焦显微镜的多物镜的两个例子示于图5中的数据包括一个60倍平场复消色差物镜油浸镜头,和一个20倍平场萤石。后者的物镜有一个调整轴环,允许它与油,甘油,或水被用作浸没介质。
适当的检体的特定显微镜的设置应设置远离感兴趣的主要区域,以避免在荧光物质中的检体的有价值区域的光漂白。 通常这需要设置在光电倍增管检测器的增益和黑电平一起针孔尺寸,以获得可接受的分辨率和足够的对比度之间的Zui佳平衡,使用Zui低的激光功率可以Zui小化光漂白。 许多仪器利用设计中设置正确的动态范围的图像,以帮助颜色查找表。 这样的表被设计成使Zui暗像素,在零附近具有亮度值,被任意地显示为绿色(例如),和Zui亮的像素,邻近255中的8位系统的亮度值,显示为红色。 显微镜参数,例如增益和黑电平及针孔的直径,被调整,使得只有几个绿色和红色的像素的图像中,以确保全动态范围从0到255被利用,但是几乎没有截止时亮度范围的任一端。 虽然这些调整可以通过眼制成,在成像系统的动态范围的极端的使用伪使得调整更主观的。 在某些情况下,图像必须被收集在低于该系统的全部动态范围,因为小于Zui佳激光功率,必须使用或检体有不均匀的荧光,导致亮区域掩盖调光区域即在帧的兴趣。

在扫描过程中的检体的图像平均化例程通常用来减少从检测系统中的随机噪声并增强常数(非随机)的特征在图像中。 图像均衡算法可以采集图像之后被应用于它们扩展到显示器的整个动态范围。 应小心不要施加这种类型的常规的,如果是向进行,除非一个控制图像被包含在相同的帧作为实验图像均衡例程之前被施加荧光强度的测量。 在使用任何类型的图像处理程序,这是一个很好的策略,以节省原材料未处理图像之外的任何处理的。
在图像采集通常的策略是保存图像到共聚焦系统的计算机的硬盘上,以后将它们备份到其他大容量存储设备。 一般情况下,始终是Zui好收集尽可能多的影像尽可能显微镜会话期间,并在以后查看舍弃不必要的。 许多图像,似乎没有必要为第一考虑成为非常有价值的,在经过进一步审查(尤其是一个人的同龄人)晚些时候。 如果它似乎浪费采取看似多余的图像,认为它更难制备另一样品,并且更难重现实验的确切条件,或甚至精确复制试样制备协议。
成像开始之前的策略在一个信息的方式标注图像文件应该得到发展。 在成像许多音符应采取或添加到图像文件连同该图像如果这种能力是可用的用于在系统上。 测试应该做的,以确保任何保存的信息是保存图像,同时要注意文本和相关的图像等信息时,它随后被转移到诸如NIH图像或Adobe Photoshop在其他图像编辑程序,可能会丢失后访问计算机。 一个组织良好的笔记本或膝上型计算机文件可能是优选的过记录成像会议细节等手段,并应包括文件名,注释和物镜的详细信息和用于允许计算比例尺在稍后的日期任何缩放因子。 大多数共聚焦系统并不自动记录中使用的物镜,并且该信息是用于计算场宽度和比例尺购买出版物重要。 许多现代系统利用该组织的文件名和文件位置的图像数据库,并且,通常将显示的图像的缩略图文件。 必须小心遵循由系统所施加的图像命名限制,诸如在文件名允许的字符的数目和是否字符,如时间或空间可能被软件被曲解。
故障排除
在任何实验学科,已产生良好效果的协议有时会莫名其妙地停止工作。 当这种情况发生时共聚焦成像实验,有可能是一个初始反射责怪工具,而不是标本,但测试应该进行,以确认该标本是没有过错的任何故障排除是开始在仪器前。 一个很好的第一次测试是查看在常规落射荧光显微镜的样品。 如果某些荧光是由眼可见,信号应该是非常光明的正常运转的共聚焦系统。 经证实,荧光存在于样品,然后应使用已知的测试样品而非实验之一来完成的共聚焦系统的一些试验。 为了参考的目的,共聚焦系统应具有试样用户可获得的显微镜,包括其收集的所有参数,例如激光功率,针孔的直径,物镜和变焦值,增益和图像的数字文件黑电平检测器的。
如果Zui初的测试不提供明确的解决方案,Zui好是寻求谁可能之前都经历过这个问题的专家的帮助。 作为一项规则,如果用户不知道的东西,它是Zui好的,他们退后一步,尝试任何补救措施之前寻求帮助。 所有供应共聚焦显微镜的公司有热线电话和网站,可以获取更多帮助来访问。
被追踪到的制备协议问题通常由试剂的降解引起的,这应该通过执行一系列的诊断测试来检查。 它通常是可取的做实验的人,以弥补他们自己的试剂,或至少从可信同事获得它们。 抗体应该从冷冻的储存在小批量进行分配,然后在冷藏下保存,并且不应该被重复使用,除非绝对必要的。 有时,这是不可避免的稀有或昂贵的试剂,而且往往不存在的一个问题。
在与多标记标本的实验中,渗出通过从一个信道到另一个可发生作为检体自身的特性的结果,或者由于出现问题的显微镜。 发表评论文献应征询的出血,经过和可能的补救措施的原因的详细信息。 仪器本身的一个很好的测试涉及测试样品与已知的渗出通过属性的成像,同时使用多标签和单标签设置。 试样的图像应与所有相关的显微镜设置的记录被存储沿,以便当确实发生的问题的试验片可以重新成像的相同的仪器条件和图像相比与存储的当仪器被称为记录要优化运行。
出现问题时,可进行其他测试包括激光照明的颜色的视觉检查和激光的阳极电压的检查。 如果,例如,一个多标签设置在扫描时从氪/氩激光光束出现的白蓝代替那么这可能表明该红线较弱。 在这种情况下,阳极电压可能会过高,并且通常可以通过调整激光的反射镜被减少到可接受的水平。 这种调整应做通过,或通过,负责维护的共聚焦系统的人员的监督。 如果电压不能被带进可接受的范围内时,可能需要替换为激光。(奥林巴斯显微镜)
可能遇到的另一个问题是,抗体探针可能具有劣化或需要进行再纯化或以其它方式清洁。 已经制备了一段时间的标本可能发展增加背景荧光和渗出通过引起从二次抗体分离并扩散到周围组织的荧光。如果可能的话,成像应进行对新制备的试样。有时改变浓度和/或荧光染料的分布将有助于缓解问题。作为一个例子,荧光素可能出血进入罗丹明信道,并且可以被切换,使得罗丹明是强信道上。这样做的理由是,该荧光激发光谱具有一个尾部重叠带而被激发的罗丹明波长范围。在随后的实验中,次级的浓度可以降低。
图像处理和公布
用共聚焦显微镜获得的图像通常被保存为一个格式,允许他们使用提供作为共聚焦系统的一部分的专用软件很容易地操纵计算机数字文件。对当前的LSCMsZui显着改善性能的共聚焦图像的显示。这是非常重要的,因为使用的共聚焦显微镜中的成像的改进的小值,如果没有办法有效地显示图像或再现它们作为硬拷贝。
就在Zui近的5年左右前,大多数实验室仍使用传统摄影暗房和胶片和纸张的化学处理图像的Zui终硬拷贝。有再现彩色图像特别的困难,因为他们通常由独立的打印机,谁往往有什么构成的显微正确的色彩平衡和质量打印的成本是很高的小主意打印。为了获得图像的硬拷贝现在,图像文件可以导出到载玻片打印机,彩色激光打印机,或染料热升华打印机出版质量的打印,可直接控制图像特征由谁收购人维持图像。的照片打印或载玻片可以直接从视频监视器屏幕进行拍摄,并且电影序列可以在网络上公布。
大部分期刊现在能够接受的数字图像文件的出版物,这导致了在公开的图像的质量的显着改善。通过共聚焦成像系统实现了图像质量,现在可以更加真实地再现发表的文章。在某些情况下,杂志也使可在CD-ROM,这意味着读者可以访问发布的图像,正是因为他们出现时,这些做研究的共聚焦系统收集他们的文章。不令人惊讶地在图像采集,显示,和公布的技术进步是在彩色图像中该杂志现在可以准确地再现图像与它们的原始分辨率和颜色平衡的情况下尤其有利,从理论上说,在低得多的成本给作者。